阅读:0
听报道

导语
二十多年来,制造有生命特征的“人造细胞”是科学家执着的追求,而现在有生物学家预测:第一个全人工合成的细胞可能会在十年内出现。如果这个细胞还能成长、分裂,无疑那将是人类巨大的进步。
编译:集智俱乐部翻译组
来源:Nature
原题:How biologists are creating life-like cells from scratch
合成一个细胞只需要八份材料:两种蛋白质、三种缓冲剂、两种脂肪大分子外加一点点化学能。这些东西就足以带来生命的脉动——和细胞类似的基本结构、反应机理甚至自我繁殖。
任职于德国马丁雷德的马普研究所(Max Planck Institute)生化所生物物理学家 Petra Schwille 认为,这些能舞动出生命韵律的细胞,是自下而上构建合成细胞工作中重要的一环。

我着迷于探究生命与非生命的边界,所合成的细胞中的每一部分的运作机理都让我渴求了解。当前的挑战是确定一个生命系统所必备的组件。—— Petra Schwille
自下而上的生物学
二十多年来,科学家一直在尝试制造出人造细胞。在恰当的条件下,将生物分子以多种机能的方式拼接在一起,使其近似表现出生命的某些特征。尽管机能众多,但可以大致分为三个方面:
区域分割(compartmentalization)
生物分子在空间上的分离;
新陈代谢(metabolism)
维持生命的生物化学体系;
信息控制(informational control)
存储、管理细胞指令。
微流体技术使科学家们可以调节微小细胞组分的运动,这个技术的迅猛发展极大地助力了这项工作。
前途光明
2017年9月,凭借荷兰万有引力计划(Gravitation Programme)提供的 1880 万欧元(2130 万美元)的资助,来自荷兰 17 个实验室的研究人员组建了 BasYC 小组(构建合成细胞,Building a Synthetic Cell),该小组的目标是在十年内构建一个类细胞的生长、分裂系统。

相关论文:
Spatial Regulators for Bacterial Cell Division Self-Organize into Surface Waves in Vitro
论文地址:
在9月份,美国国家科学基金会( NSF )也宣布了第一个合成细胞项目,资助金额高达一千万美元。
此外,Petra Schwille 等欧洲研究员提出了一个建造合成细胞的项目,作为欧盟委员会未来和新兴技术的旗舰计划,该项目获得了 10 亿欧元的资金支持。
参与这样自下而上构建生命项目的生物学家预测:第一个全人工合成的细胞可能会在十年内出现。
我肯定我们能做到这一点。—— Petra Schwille
像包饺子一样“包细胞”
研究者取得了诸多方面的进展,特别是在模拟类细胞膜结构和细胞内部膜结构方面有所突破。因为让零散的生物分子一起工作的关键就是,把他们在正确的时间、正确的地点“包”在一起。
比如说,我们可以把 10 亿个细菌像拆快递一样都拆开,然后将里面的东西倒进一个试管中,试管中的物质相当丰富,但其中的生物反应缺持续不了太久。就是因为其中的成分该分开的没给人家分开,不该在一起的都凑到一块去了。就好像吃饺子要一个一个连皮带馅一起吃,不能先吃一碗饺子馅,再吃一盘饺子皮。
“摇元宵”

在大多数情况下,这意味着要把生物分子安置到脂膜(lipid membranes)上,或者内部。Schwille 和她的研究小组成员是研究脂膜的行家里手。
大约十年前,Schwille 的研究生 Thomas Litschel 及其合作者将 Min 蛋白质溶解在水中,将混合物的液滴放置在快速旋转的试管中,离心力促使液滴包裹上一层致密的脂质。
最终形成一个和细胞差不多大的脂质泡(囊泡)。这种脂质泡被称作巨型单层囊泡(giant unilamellar vesicles,GUVs)。
这个脂质泡直径 10-20 微米。
这样的脂质泡能用不同的方法制造,然而在研究向人工脂膜中添加能引导细胞分裂所必需的 Min 蛋白时,研究者们发现这些蛋白会从膜上弹出来,这会给膜结构带来震颤。结果就是添加这种蛋白质后产生的囊泡会像肥皂泡一样破裂。
不过 Schwille 的团队已经使用微流体技术攻克了这一难题。他们能够构建细胞大小的囊泡,并且能够接受蛋白质穿插或嵌入其中。
“泡泡机”

这就是分子社会学。——Cees Dekker,代尔夫特理工大学生物物理学家
Cees Dekker 的团队成员用微流控芯片将他们期望的蛋白质注入到脂质泡中,这种方法被称作:OAL法(辛醇辅助脂质体组装方法,Octanol-assisted liposome assembly),也叫泡泡机。
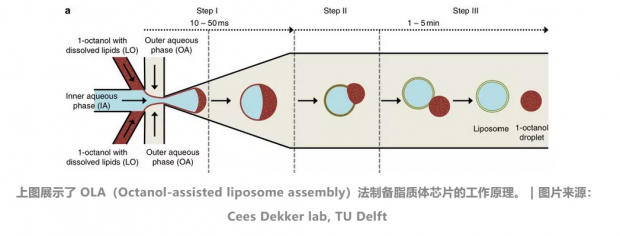
在图左侧中蓝色是注入的“墨水”,可以在其中注入蛋白质,或其他荧光标记物质,用于检测脂膜有无破损泄露(包饺子不能露馅);红色部分是混合了脂质的正辛醇;米白色是提供压力和液体环境的水溶液。
图 a 告诉我们 OLA 法形成脂质泡也分三步。
第一步:通过水溶液挤压出乳状液滴。
第二步:在“泡泡”的界面形成脂质分子层,而正辛醇与多余脂质一起形成一个小鼓包。这一点与肥皂泡同理,多余的肥皂液体也会聚在肥皂泡表面形成一个小鼓包。
第三步:这个“小鼓包”自动分离形成一个小液滴。一个由脂膜包裹的“泡泡”就制作完成了

赐予细胞力量吧
所有生命都需要能量,特别的是以三磷酸腺苷(ATP)形式存在的能量。虽然可以从外界给细胞注入能量,但作为一个能够自主运转的体系,一个细胞也应该有自己的发电厂。在自然界中,动物的线粒体和植物的叶绿体就是提供 ATP 的发电厂。
流水线
德国马普研究所医学所的 Joachim Spatz 团队已经建立了一个能够在囊泡内产生 ATP 的基本线粒体。
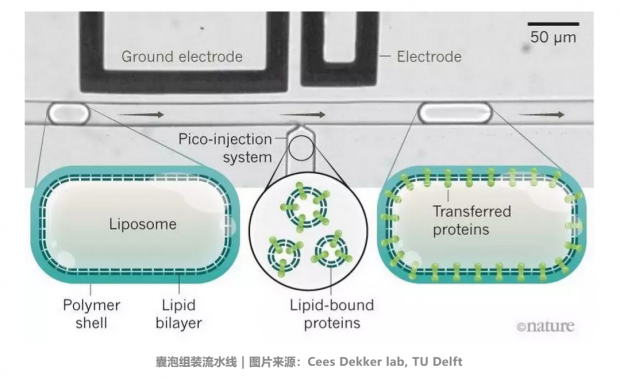
他们使用微流体技术实现了这一目标。
首先,为了稳定 GUVs,研究者把 GUVs 置于有粘性的聚合物层(Polymer shell)中,GUVs就像在流水线上移动的待组装的零部件一样,沿着给定的微小管道流动,当囊泡通过图中的微注射系统(Pico-injection system)时,由电极产生的电脉冲就能引导由脂质包裹的蛋白质(Lipid-bound proteins)和囊泡合并。通过这样的手段,研究者就可以把特定的蛋白质注入到囊泡内部或囊泡膜的表面。
GUVs:上文提到的巨型单层囊泡(giant unilamellar vesicles)
研究者给囊泡“上传”了 ATP 合成酶(ATP synthase),这种酶就像一个分子级别的水车轮,当质子流过膜时,就能产生出 ATP。可以在溶液中加入酸,就能提供足够多的质子。该团队的工作使得囊泡能够从自身内部生成 ATP。
Spatz 说,这样的流水线可以循环利用,研究者也可以注入另外的蛋白质,或按顺序添加相应对的组分。这是个非常基本但极其重要的步骤。
光合作用
由生物化学家 Tobias Erb 领导的马普研究所的另一个合成生物学小组一直在研究构建细胞代谢途径的其他方法。该小组研究的重点是能进行光合作用的微生物从环境中吸收二氧化碳,产生糖分和其他物质的方法。他们决定从白手起家做起设计一个新的光合作用的方法。
从工程的视角来进行设计,然后在实验室里造出来——Tobias Erb
他们团队设计了一个系统:将二氧化碳转变成苹果酸(光和作用中重要的代谢产物)。他们认为,这个方法比光合作用更加有效。
检索、实验了每一种酶,并对少数的酶加以改造,最终他们得到了来自 9 种不同生物体的 17 种酶,部分酶来自包括大肠杆菌、古细菌、拟南芥和人类。虽然这些酶的反应效率比意料之中低,但经过进一步实验,他们团队得到的最终结果比光合作用的效率高了 20%。
小组下一步工作是构建一个粗糙的叶绿体。他们从搅碎的菠菜汁中提取出能进行光合作用的成分,将其加入到试管中的酶系统中。生物学家发现仅进行紫外光照射就能够促进 ATP 的生成和二氧化碳向苹果酸的转化。
Erb 表示尽管在试管中这些反应能进行一段时间,但他们的希望是,这些反应的组分能像叶绿体一样被划分在一个细胞器内。为了建造和控制复杂的分隔结构他们与合成生物学家 Kate Adamala 进行了合作。

位于明尼阿波利斯的明尼苏达大学的 Adamala 研究小组正在探索如何构建可编程生物反应器。在囊泡中引入简单的基因,并将它们融合在一起,由此创建更复杂的生物反应器。她将这些称之为“能造蛋白质的肥皂泡”。
和 Schwille 类似,她们团队也使用“摇元宵”系统来构建这些生物反应器,但产生的囊泡更小。并且研究者在其中注入了可以执行功能、制造蛋白质的 DNA 质粒。例如,她们已经制造了能对环境中的抗生素做出生物光反应的囊泡反应器。

通过将简单的部件组装进一个细胞,研究者可以构建更为复杂的基因回路。但是,当这样的系统扩展到 10 个左右得到组件时,构建的体系开始崩溃。Adamala 认为这是一项重大的挑战,在真是的细胞中,有些蛋白质彼此会互相干扰,无法在一起工作,应该被细胞内的其他结构、成份分隔开。
对于更简单的合成细胞而言,科学家可以找到其他的方法:比如人为地从外界控制囊泡融合的时间;通过化学标签来决定囊泡是否融合;或者设置一个延时释放系统等等。
信息与演化
制作细胞的另一个问题是软件。生物信息必须按照一定的方式存储检索,才能让人工合成的细胞按照科学家的指令复制、分裂。对于生命系统而言,这项工作是依靠基因完成的,从只有数百个基因的微生物,到坐拥数以万计基因的人类皆是如此。
有一个问题:一个合成的细胞最少需要多少基因才能实现自我繁衍?这是一个有争议的问题。Schwille 和其他人认为或许保留几十个基因就够了。然而其他人,比如 Adamala 就认为一个细胞需要 200-300 个基因。
有的科学家选择用活物做实验,加州拉荷亚 J. Craig Venter 研究所( JCVI )的合成生物学家 John Glass 和他的同事们采集了地球上已知最小的微生物,丝状支原体(Mycoplasma mycoides)的基因组,并系统性有计划地去破环它的基因。根据细胞的死活或生长情况,就能确定那个被移除的基因是不是至关重要的。一旦他们能够确定哪些基因是必不可少的他们就能在实验室中用化学的方法把最小的基因组拼起来。

在这个试验中合成了一个包含 473 个基因的基因组,这大概是原始生物基因数量的一半。这个人工合成的基因组被移植到了一个相关的细菌物种:山羊支原体(Mycoplasma capricolum)。
根据他们 2016 年的工作显示这个最小的基因组可以“启动”生命系统,一个生长缓慢的生命系统。Glass 认为这已经是极限了,再移除一个基因,细胞可能停止生长乃至死亡。
编写蓝图
Glass 和他在 JCVI 的同事正在编制一个"细胞任务"列表: JCVI-syn3.0a,这个将成为是细胞的最小待办事项(To-do List)的蓝图。但是,还有一百多个基因不可或缺的原因尚不清楚。
在受到国家科学基金近100万美元的资助后,他们下一步的工作是把 JVI-Syn3.0a 基因组安装到合成的膜泡中,让这个膜泡就成为了一台 DNA 编译蛋白质的机器,并观测是否成功。倘若如此,细胞的软硬件系统就合为一体了。
如果这个细胞还能成长、分裂,那将是一个巨大的进步。但更多的人认为,如果真的想演示出一个生命系统的功能,这个人工细胞也必须能适应环境,不断演化。这是我们还无法预测的事情,也是终极的挑战。
看到一个细胞由死到活,我已经很高兴了。但为了能让一个细胞生存下去,还有新的机能要去实现。——Petra Schwille
相关论文:
Beating Vesicles: Encapsulated Protein Oscillations Cause Dynamic Membrane Deformations
论文地址:
JCVI 的 Glass 团队一直在用 JVI-Syn3.0a 基因组进行实验,并人工选择在营养物中生长的更快的个体。到目前为止,经过了 400 次分裂以后,研究者们已经获得了比原始细胞生长速度快 15% 的新细胞。并且他们也看到了基因序列的变化。但是目前并没有证据表明这些细胞能演化出新的机能,或者增强了适应能力。
Erd 认为:具备演化的能力的合成细胞才有价值。在生物系统中添加一点点的混乱,就能让它们提高自己的机能。作为工程师我们无法制造出完美的细胞,但是我们必须建立一个能随着时间推移不断纠错、自我改进的系统。
一路求索
人工合成的细胞能为我们了解其他星球上的生命形态带来启发。并且,在完全受控的情况下,合成生物反应器可能为治疗癌症、解决抗生素抗药性或清理毒害地区提供新的解决方案。把这样的有机体释放到人体或环境中可能存在风险,然而其他的办法的风险可能更大。
Dogterom 认为合成细胞或许会带来哲学和伦理学问题:这是一种生命么?这些细胞是自主的么?还是受人类控制的?但对于大众关心的人工合成细胞是否会失控这一问题,她并不担心。研究者和工程师能轻易地给细胞加入控制装置或者“开关”,令细胞无害。
时机恰到好处,我们拥有了基因组,配件表,只需要数百个基因就能装配好最小的活细胞,这都令人兴奋。虽然数以百计的组件是一个巨大的挑战,但庆幸不是上千个。——Dogterom
研究者们仍将继续前行。
翻译:Leo
审校:李周园
编辑:王怡蔺
原文:
话题:
0
推荐
财新博客版权声明:财新博客所发布文章及图片之版权属博主本人及/或相关权利人所有,未经博主及/或相关权利人单独授权,任何网站、平面媒体不得予以转载。财新网对相关媒体的网站信息内容转载授权并不包括财新博客的文章及图片。博客文章均为作者个人观点,不代表财新网的立场和观点。




 京公网安备 11010502034662号
京公网安备 11010502034662号 